点击蓝字关注我们


本世纪初以来,在肾移植领域抗体介导排斥反应 (antibody‑mediated rejection,AMR)日益受到重视。越来越多的证据显示AMR是影响移植肾长期存活的最大障碍,约60%的移植肾失功与其有关[1]。
AMR诊断现状:
目前AMR诊断金标准是病理活检,但活检属于有创操作,且穿刺时机的把握、病理异质性及阅片专家的经验都会影响结果的准确性。
DSA是导致AMR的主要病因,DSA分为预存DSA(preformed DSA,pfDSA)和新生DSA(de novo DSA,dnDSA)。迄今为止,对于慢性活动性AMR的治疗尚未形成统一方案。临床研究发现,dn DSA引起的AMR在诊断后8年移植肾生存率仅为34%[2]。早期发现DSA意味着能够早期发现移植肾发生排斥反应,及早地进行干预治疗,对于延缓这种慢性病变的进展具有重要意义。
DSA检测短板:
目前,临床上检测DSA的常用方法是单抗原微珠法(single antigen beads,SAB)。SAB敏感性高,可以明确抗体种类。但是受试剂携带抗原种类数目的限制和抗原制备过程中变性等因素的影响,DSA在检测方面存在漏检和假阳性的情况。
在临床诊断方面,DSA检测没有统一的阳性阈值标准,每个移植中心的判断标准都不一样。同时,DSA阳性到AMR病理损伤需要一定的时间,而且DSA阳性也不一定就造成AMR病理损伤。因此,DSA检测在预警AMR方面还存在不足和短板。
GcfDNA补DSA检测短板:
移植器官发生损伤时降解的DNA片段会释放到血浆中,称为移植物来源细胞游离DNA(Graft-derived Cell-free DNA,GcfDNA)。GcfDNA浓度与移植肾损伤密切相关,是器官早期损伤的敏感标志物。
Bu L等人开展的临床研究共纳入了1092 名肾移植受者,随访时间3年,对其中的961名患者进行了评估,发现GcfDNA升高与临床/亚临床排斥反应的发生显著相关[3]。以下两点是该研究的部分详细内容:
1、GcfDNA是器官损伤的重要早期敏感标志物
研究分析了GcfDNA在判断肾脏损伤中的临床价值。研究将肾脏损伤定义为:他克莫司浓度水平(<4ng/ml 或 >12ng/ml)、BK病毒血症、dnDSA阳性、尿路感染、蛋白尿、出现移植物排斥或复发局灶性节段性肾小球硬化。
在该研究中,共467例患者出现肾损伤,而GcfDNA在损伤发生前30天即出现了升高,损伤组和非损伤组的GcfDNA水平存在明显差异(0.51% vs 0.21%,P<0.0001)(图1)。
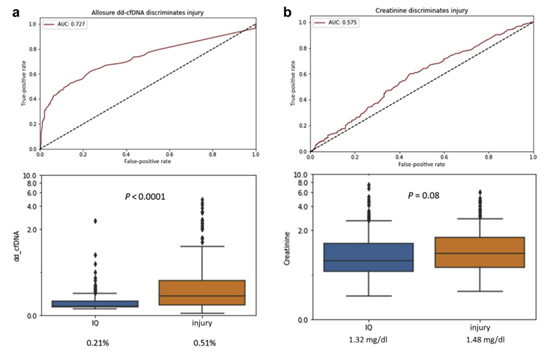
图1:GcfDNA与肌酐在肾损伤中的诊断性能比较
2、GcfDNA升高伴随着dnDSA产生风险增加
研究还发现,当患者GcfDNA>0.5%,其未来出现dnDSA的风险升高3倍(HR 2.71,p=0.001)(图2),且GcfDNA在dnDSA阳性前91天(四分位数:30-125天)即可出现升高。
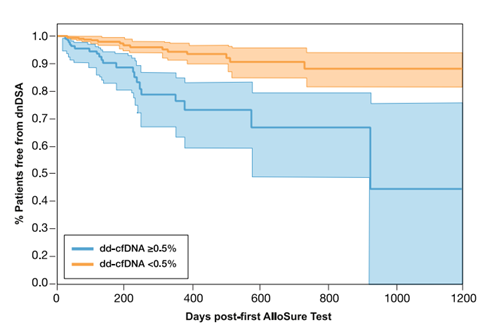
图2:GcfDNA与dnDSA发生率的Cox比例风险模型
GcfDNA检测建议:
-
建议术后1月内完成GcfDNA的首次检测,以确定基线GcfDNA水平。早期较高的GcfDNA提示患者存在发生急性排斥反应的风险。
-
调整免疫抑制治疗方案期间注意随访GcfDNA水平,及早发现因免疫抑制不足导致的排斥反应。
-
术后长期随访过程中,定期监测GcfDNA以评估发生dnDSA及移植物功能损伤的风险。根据参考文献,考虑实际情况,我们建议在术后1、3、6、9、12月各进行1次GcfDNA检测,此后每季度进行1次GcfDNA检测[4]。
总结
1、AMR目前诊治都面临很多困难;
2、DSA监测在AMR预警中具有重要意义;
3、DSA检测存在短板,同时DSA临床结果判读标准不一,临床应用存在局限;
4、GcfDNA可反应移植物损伤,弥补DSA短板,提高AMR诊断性能;
5、移植患者术后建议动态监测GcfDNA,尤其在术后1年内需加强监测频率。
参考文献:
[1] 崔瑜, 张雷, 吴建永 . 肾移植抗体介导排斥反应的预防及诊疗要点[J]. 中华医学杂志, 2022, 102(26): 2041-2044. DOI: 10.3760/cma.j.cn112137-20220520-01117.
[2]中国医药生物技术协会移植技术分会, 上海市肾脏移植质控中心专家委员会 . 肾移植后期抗体介导排斥反应防治专家共识[J]. 中华医学杂志, 2022, 102(26): 1973-1981. DOI: 10.3760/cma.j. cn112137-20220129-00217.
[3]Bu L, et al. Clinical outcomes from the Assessing Donor-derived cell-free DNA Monitoring Insights of kidney Allografts with Longitudinal surveillance (ADMIRAL) study. Kidney Int. 2022 Apr;101(4):793-803. doi: 10.1016/j.kint.2021.11.034.
[4] Pai A, et al. Clinical Rationale for a Routine Testing Schedule Using Donor-Derived Cell-Free DNA After Kidney Transplantation. Ann Transplant. 2021 Jul 2;26:e932249. doi: 10.12659/AOT.932249.


