点击蓝字关注我们


器官排斥反应是器官移植领域的主要问题,移植后监测可以避免移植物过早失功。供体来源游离 DNA(GcfDNA,又称为ddcfDNA)是器官移植无创性液体活检的主要生物标志物,GcfNDA动态监测是移植物损伤检测领域的研究热点,其中ddPCR、NGS是ddcfDNA常用的检测方法。
ddPCR因耗时短、成本低、操作简便,在GcfDNA动态监测中非常具有前景。
GcfDNA 作为器官移植术后生物标志物,能预警排斥反应包括ABMR以及TCMR等,其中ABMR诊断的敏感度和特异度较高,并能够对移植物损伤进行动态监测,可以避免移植物过早丢失以及不必要的穿刺活检。
GcfDNA 常用的检测方法主要包括数字PCR技术(ddPCR)、高通量测序技术(NGS)等1-4。
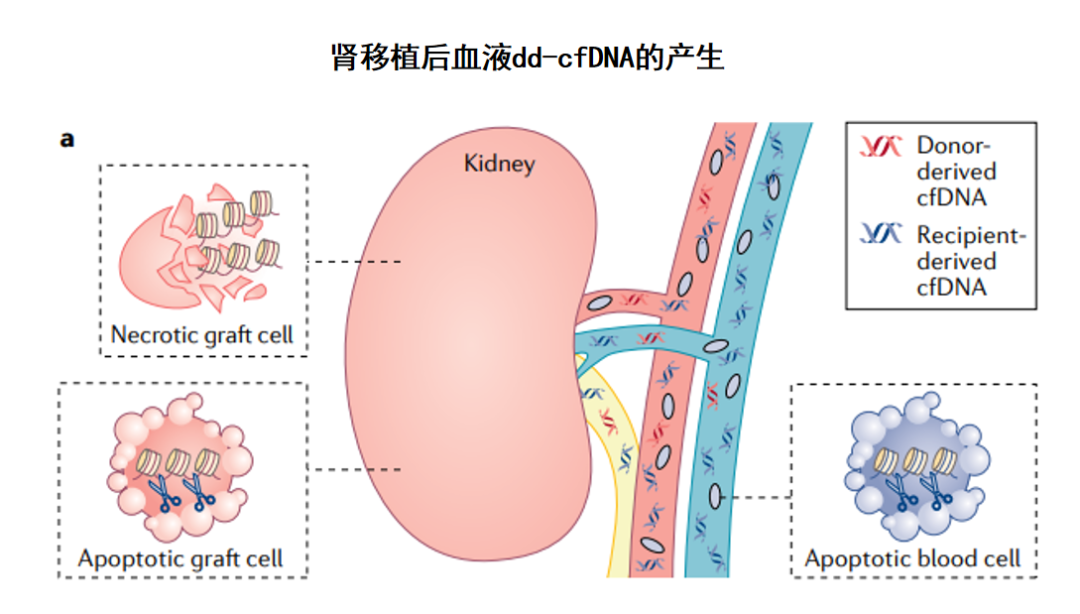
移植肾的细胞凋亡或坏死将供体来源的游离DNA(dd-cfDNA)释放到血液中,但是它仅占受体血液中总cfDNA的一小部分,受体来源的cfDNA主要起源于造血系统的凋亡细胞。
ddPCR和 NGS检测方法是GcfDNA的定量检测方法,ddPCR与传统qPCR技术不同,可以进行绝对定量。
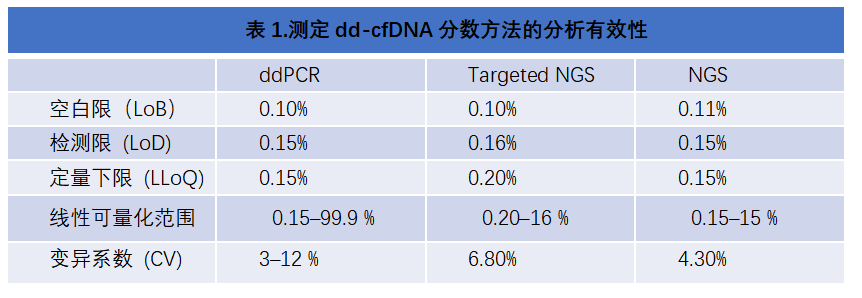
ddPCR和NGS的有效性分析报告显示,在空白限(LOB)、检测限(LOD)、定量下限(LLoQ)和变异系数(CV)方面有相似的性能,但 ddPCR的线性可定量范围(0.15-99.9%)比 NGS(0.15-15%)宽得多(表1)。
在肝脏移植中,GcfDNA可超过16-20%这个范围,这限制了NGS的应用4。因NGS通过使用统计模型根据测量的等位基因计数推断受体和供体的基因型来将SNPs分类为供体和受体,通过这种方法,高比例供体等位基因将与受体的杂合子状态难以区分,由于建模必须解释文库制备和测序期间引入的变异性,这些方法的定量上限为16-20%。
而ddPCR的动态范围高达99%,因为它们涉及受体基因分型,而不是统计方法1。
另外,ddPCR与NGS相比,检测耗时短,成本低。NGS的检测结果通常在2-3个工作日获得,而 ddPCR的检测结果可以在1个工作日获得1。
GcfDNA动态监测为器官移植带来了经济学效益,与肾活检相比,GcfDNA动态监测的成本更低,并且能够降低再移植或透析的成本,以德国肾移植术后第一年常规进行GcfDNA检测为例,使用ddPCR的总费用为4012美元,分别在第7、14、30天和第2、3、4、5、6、9、12个月做检测,在接下来的几年中,在第 3、6、9 和 12 个月后进行检测,使用 ddPCR 每年的费用为 1604 美元,这些费用都是基于德国 GOA 的官方报销计划,每次肾移植GcfDNA检测可报销401美元。
而再次肾移植的费用为72150至111891美元,恢复透析的费用为60802至75836美元/每年。
而使用NGS检测成本将大幅增高,GcfDNA检测需要实验室仪器(如ddPCR或NGS仪器),一个中等大小的 Illumina系统,如NextSeq 550的成本约为347 000美元,MiSeq的成本约为130 000美元,另外还有其他成本费用,而一个 QX200 ddPCR设备(Bio-Rad)的成本约为44 000美元4。
总之,ddPCR可动态监测移植术后器官损伤与排斥反应等,如肾移植术后长期动态检测,监测肾损伤,预警ABMR,减少因ABMR给病人带来的高昂医疗费用,及不可逆的功能损伤,达到早发现,早诊断,早治疗的目的;同时凭借其无创、检测耗时短,成本低,可定量范围宽等优势,让ddPCR适用于不同器官移植(非多器官)术后长期低成本监测。
参考文献:
1、 Oellerich M, et al.Liquid biopsies: donor-derived cell-free DNA for the detection of kidney allograft injury. Nat Rev Nephrol. 2021;17(9):591-603.
2、 Gielis, E. M. et al. The use of plasma donor- derived,cell- free DNA to monitor acute rejection after kidney transplantation. Nephrol Dial Transplant. 2020,35:714–721.
3、 Stites, E. et al. High levels of dd- cfDNA identify patients with TCMR 1A and borderline allograft rejection at elevated risk of graft injury. Am. J. Transplant. 2020,20:2491–2498.
4、 Oellerich M,et al.Donor-Derived Cell-Free DNA Testing in Solid Organ Transplantation: A Value Proposition.J Appl Lab Med . 2020;5(5):993-1004.
扫码关注我们
微信号|Tx新方案
健耕医药,专注移植产业



