器官短缺是目前器官移植领域面临的一个主要挑战[1]。尽管美国的器官移植数量在逐年增多,并在2022年实施了超过42800例器官移植(约25000例为肾移植) [2],但仍有超过100000的等待移植患者(87% 等待肾移植)[3]。随着供体器官机械灌注技术逐步应用于临床,早期被遗弃的边缘性供体器官正越来越多地被临床所接受,用来实施器官移植以拯救更多病人的生命[1] 。
边缘性(Marginal)供体器官是指质量较差的器官,利用这些器官实施器官移植后,器官存活率和受者存活率都明显降低[1, 4, 5] 。但采用适当的措施可使很多边缘性供体器官被利用,且移植后的结果在临床上是可接受的[1] 。目前,增加边缘性供肾利用并改善移植后临床结果的主要措施方案为:1)结合供体病史、实验室检查及器官质量评分(如ECD、DCD、KDPI等),对供体肾脏进行质量评估, 并对供受体实施最佳匹配;2)选择最佳手术方案,以减少器官的热缺血时间(WIT)和冷缺血时间(CIT),在供体手术中对器官进行直观评估,以及肾活检对边缘性供肾的进一步评估;3)供体手术获取肾脏后的机械灌注[6] 。本文主要对边缘性供肾的供体术前、术中评估以及供肾获取后的体外机械灌注进行阐述。
01
供体手术前肾脏的评估
供体肾脏的质量决定了移植后的临床结果。供体病史、肾功能检查、器官质量评分可帮助对肾脏质量进行评估。
1.1扩大标准供体
(Expanded-criteria-donor,ECD)
ECD于2002年获美国器官获取移植网络(Organ Procurement and Transplantation Network, OPTN)论证审批,将其作为评估供体肾脏质量的一个指标。ECD主要是指死亡供体年龄 >60岁或年龄在50-59岁间具备下述三个指标中的两个:1)高血压病;2)血肌酐(Cr)>1.5 mg/dL;3)死因为脑血管意外[7] 。相对于标准供体而言,ECD肾脏移植后肾脏功能恢复延迟(DGF)的概率明显增多[7, 8]。早期临床实践显示,ECD肾脏移植后移植肾的预期寿命约为5.1年,而标准供肾的预期寿命约为10年[7],故在进行供受体匹配时,应尽量考虑不要把ECD肾脏用于较年轻的受体。
1.2肾脏供体概况指数 (KDPI)
KDPI 是评估死亡供体肾脏质量的一个评估系统。KDPI通过供体的10个参数计算后得到一个百分数值(%),用来预估移植后供肾的存活时间[9] 。美国从2014年年底开始使用KDPI评估系统实施供体肾脏的分配,移植中心可根据不同受体的具体情况选择不同KDPI的肾脏,也可根据KDPI值来决定是否接受此供肾用于移植 [4, 10] 。KDPI值可大体预估移植肾脏的工作年限 (图1),较高KDPI供肾的预期寿命相对较短,故在进行供受体匹配时,应尽量考虑不要把太高KDPI的供肾(如KDPI >85%)用于较年轻的受体,特别是儿童受体。
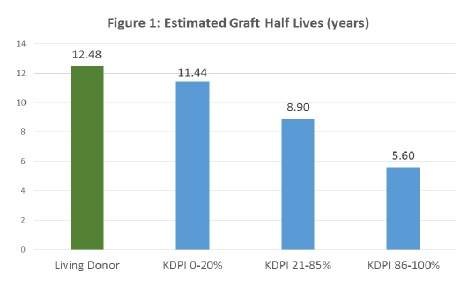
图1. KDPI预估肾移植后肾脏的存活时间 [9]
02
供体手术方式的选择和器官质量的评估
2.1不同供体获取手术方式的选择
选择最佳的手术方案可以缩短WIT和CIT,增加心死亡供体(DCD)供肾的利用率及改善移植后的临床结果。脑死亡供体(DBD)一般采用常规的供体手术方式,对DCD供体目前主要采用快速阻断并灌注法[11]。近年来,体内常温局部灌注(Normothermic reginal perfusion, NRP )[12] 也越来越多地应用于临床(图2)。使用NRP后能明显地增加DCD器官的利用率,并改善移植后的结果(图3)[13, 14]。
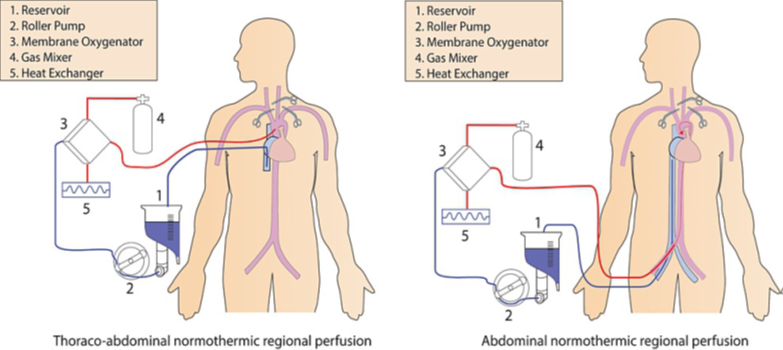
图2. 体内区域性常温灌注 (In Situ – NRP)
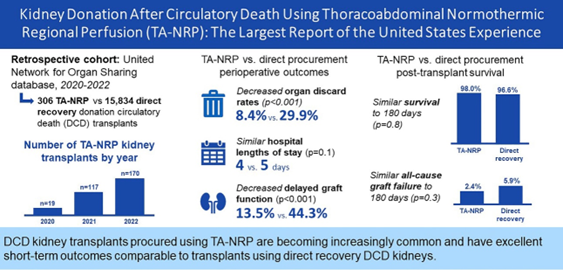
图3. NRP对DCD供体肾脏的作用
2.2肾脏活检 (Biopsy)
除外科医生对肾脏的评估外,肾脏活检可帮助器官质量的评估。肾脏病理活检属于有创性检查,是否作为供体肾脏评估的常规检查目前存在争议[15] 。但肾活检能在较短的时间内得到慢性肾脏疾病的病理变化 (如:肾小球硬化 (GS)、肾间质纤维化 (IF)、肾血管改变 (VC)等)。慢性病理变化越严重,移植肾脏的工作年限越短(图4)。故临床上仍在移植前对“边缘性”供体,特别是存在慢性肾脏病史(如高血压、糖尿病、供体手术前肾功能检查存在异常)的肾脏实施肾活检,以评估此供体肾脏能否使用,并将病理结果作为供受体匹配时的考虑因素[16] 。总体来说,多数移植中心把具有GS/IF/VC损伤超过10%作为实施肾移植的临界值。
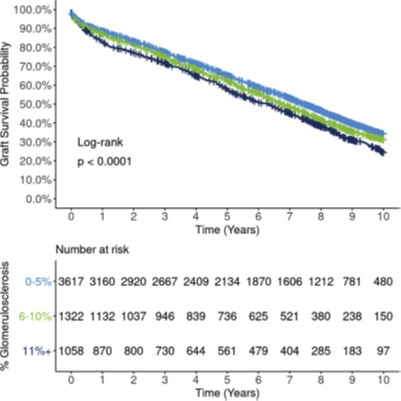
图4. 供体肾小球硬化率同移植后
肾脏存活的关系[16]
03
供体手术后肾脏的机械灌注
利用近年发展起来的器官机械灌注技术包括体内的常温局部灌注(NRP)和体外机械灌注 (Ex situ machine perfusion, ESMP),可增加边缘供体器官的利用率,并改善移植后的临床结果[13, 17]。ESMP主要分为低温机械灌注 (HMP)和常温机械灌注 (NMP)。
3.1 低温机械灌注
低温机械灌注 (HMP)能在一定程度上改善供体肾脏的血流动力学,灌注期间将可能对肾脏产生损害的物质(如氧自由基)引流出肾脏,此外还可在灌注期间加入改善肾脏功能的药物(如加入血管舒张药以改善肾脏的血流动力学性能)。使用HMP能明显减少DGF的发生率,并改善移植后供肾的1年存活率(图5) [17] 。3年随访发现,相较于传统静态冷保存,使用HMP使ECD供肾的存活率提高10%。目前,供体肾脏的体外低温机械灌注技术已从科研实验阶段逐步进入到常规的临床工作应用阶段[18] 。
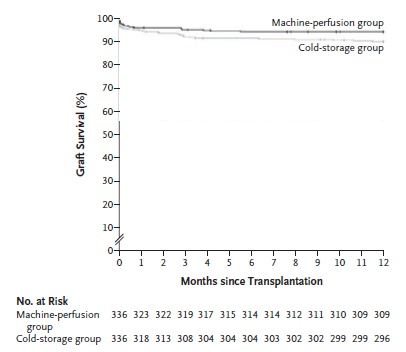
图5. LifePort改善移植后供体肾脏的1年存活率 (p <0.05)[17]
目前临床上应用最广的HMP为LifePort Kidney Transporter® (图6)。自LifePort于2003年7月获美国FDA论证审批后 [19] 至今,全球已有超过175000例供体肾脏经过LifePort体外机械灌注后移植到了病人体内,挽救了病人的生命[20] 。总体来说,美国许多移植中心把HMP 6 小时后肾血流量 <80 mL/min 和肾血管阻力 >0.5 mmHg/mL/min 作为接受或不接受此供肾的临界值。

图6. LifePort Kidney Transporter®
3.2 常温机械灌注
供体肾脏的体外常温机械灌注(NMP)正在临床科研试验阶段[21] 。初期的结果表明NMP可进一步在移植前对供体肾脏进行评估,增加“边缘性” 供肾的利用,并改善移植后的临床结果 [18, 22, 23]。
结论
美国近年来捐献数和移植数的提升离不开边缘供体的大量使用。注重边缘性供肾的质量评估、供体和受体进行较佳匹配、选择最佳供体手术方案以及供体术后利用体外机械灌注技术等方案可增加边缘性供肾的利用率,并进一步改善移植后的临床结局。
Referances
[1] Ravaioli M, De Pace V, Angeletti A, et al. Author Correction: Hypothermic Oxygenated New Machine Perfusion System in Liver and Kidney Transplantation of Extended Criteria Donors: First Italian Clinical Trial [J]. Sci Rep, 2020, 10(1): 14658. DOI: 10.1038/s41598-020-70620-y.
[2]Unos. 2022 organ transplants again set annual records [M]. 2023: https://unos.org/news/2022-organ-transplants-again-set-annual-records/.
[3]Americankidneyfund. Transplant waiting list [M]. 2023: https://www.kidneyfund.org/kidney-donation-and-transplant/transplant-waiting-list.
[4]Maggiore U, Cravedi P. The marginal kidney donor [J]. Current opinion in organ transplantation, 2014, 19(4): 372-380. DOI: 10.1097/mot.0000000000000081.
[5]Noble J, Jouve T, Malvezzi P, et al. Transplantation of Marginal Organs: Immunological Aspects and Therapeutic Perspectives in Kidney Transplantation [J]. Front Immunol, 2019, 10(3142. DOI: 10.3389/fimmu.2019.03142.
[6]Warmuzińska N, Łuczykowski K, Bojko B. A Review of Current and Emerging Trends in Donor Graft-Quality Assessment Techniques [J]. Journal of clinical medicine, 2022, 11(3). DOI: 10.3390/jcm11030487.
[7]Rao PS, Ojo A. The alphabet soup of kidney transplantation: SCD, DCD, ECD–fundamentals for the practicing nephrologist [J]. Clin J Am Soc Nephrol, 2009, 4(11): 1827-1831. DOI: 10.2215/cjn.02270409.
[8]Sharif A. Deceased Donor Characteristics and Kidney Transplant Outcomes [J]. Transplant international : official journal of the European Society for Organ Transplantation, 2022, 35(10482. DOI: 10.3389/ti.2022.10482.
[9]Optn. Kidney Donor Profile Index (KDPI) Guide for Clinicians [M]. 2023: https://optn.transplant.hrsa.gov/professionals/by-topic/guidance/kidney-donor-profile-index-kdpi-guide-for-clinicians/.
[10]Dahmen M, Becker F, Pavenstädt H, et al. Validation of the Kidney Donor Profile Index (KDPI) to assess a deceased donor’s kidneys’ outcome in a European cohort [J]. Sci Rep, 2019, 9(1): 11234. DOI: 10.1038/s41598-019-47772-7.
[11]Hessheimer AJ, Polak W, Antoine C, et al. Regulations and Procurement Surgery in DCD Liver Transplantation: Expert Consensus Guidance From the International Liver Transplantation Society [J]. Transplantation, 2021, 105(5): 945-951. DOI: 10.1097/tp.0000000000003729.
[12]Alamouti-Fard E, Garg P, Wadiwala IJ, et al. Normothermic Regional Perfusion is an Emerging Cost-Effective Alternative in Donation After Circulatory Death (DCD) in Heart Transplantation [J]. Cureus, 2022, 14(6): e26437. DOI: 10.7759/cureus.26437.
[13]Bekki Y, Croome KP, Myers B, et al. Normothermic Regional Perfusion Can Improve Both Utilization and Outcomes in DCD Liver, Kidney, and Pancreas Transplantation [J]. Transplantation direct, 2023, 9(3): e1450. DOI: 10.1097/txd.0000000000001450.
[14]Zhou AL, Leng A, Ruck JM, et al. Kidney Donation After Circulatory Death Using Thoracoabdominal Normothermic Regional Perfusion: The Largest Report of the United States Experience [J]. Transplantation, 2023, 10.1097/TP.0000000000004801. DOI: 10.1097/tp.0000000000004801.
[15]Lentine KL, Fleetwood VA, Caliskan Y, et al. Deceased Donor Procurement Biopsy Practices, Interpretation, and Histology-Based Decision-Making: A Survey of US Kidney Transplant Centers [J]. Kidney Int Rep, 2022, 7(6): 1268-1277. DOI: 10.1016/j.ekir.2022.03.021.
[16]Stewart DE, Foutz J, Kamal L, et al. The Independent Effects of Procurement Biopsy Findings on 10-Year Outcomes of Extended Criteria Donor Kidney Transplants [J]. Kidney Int Rep, 2022, 7(8): 1850-1865. DOI: 10.1016/j.ekir.2022.05.027.
[17]Moers C, Smits JM, Maathuis MH, et al. Machine perfusion or cold storage in deceased-donor kidney transplantation [J]. The New England journal of medicine, 2009, 360(1): 7-19. DOI: 10.1056/NEJMoa0802289.
[18]López-Martínez S, Simón C, Santamaria X. Normothermic Machine Perfusion Systems: Where Do We Go From Here? [J]. Transplantation, 2023. DOI: 10.1097/tp.0000000000004573.
[19]Signa. Kidney Transplantation, Pancreas-Kidney Transplantation, and Pancreas Transplantation Alone [M]. Medical Coverage Policy. 2023: 0146.
[20]Medicaldesigndevelopment. LifePort Kidney Transporter Awarded Exclusive Contract in Belgium [M]. 2023: https://www.medicaldesigndevelopment.com/topics/surgical/news/22485822/lifeport-kidney-transporter-awarded-exclusive-contract-in-belgium.
[21]Choudhary D, Sharma A, Singh S, et al. Application of Ex Vivo Normothermic Machine Perfusion in Deceased Donors With Acute Kidney Injury With Successful Renal Transplantation: A Preliminary Experience [J]. Transplantation direct, 2022, 8(11): e1391. DOI: 10.1097/txd.0000000000001391.
[22]Fard A, Pearson R, Lathan R, et al. Perfusate Composition and Duration of Ex-Vivo Normothermic Perfusion in Kidney Transplantation: A Systematic Review [J]. Transplant international : official journal of the European Society for Organ Transplantation, 2022, 35(10236. DOI: 10.3389/ti.2022.10236.
[23]Zulpaite R, Miknevicius P, Leber B, et al. Ex-vivo Kidney Machine Perfusion: Therapeutic Potential [J]. Front Med (Lausanne), 2021, 8(808719. DOI: 10.3389/fmed.2021.808719.


