前言
随着肾移植取得巨大进展,肾移植术后并发症、免疫抑制药物调整等均会影响移植物的功能与存活,移植物术后的动态监测越来越受到关注,移植物监测传统上依赖于血清肌酐和肾脏活检。
但血清肌酐检测较为滞后,缺乏敏感性,不能发现早期肾损伤。肾脏活检因具有侵入性、出血等风险,不适合频繁监测。
供体来源的游离DNA(GcfDNA,临床上又称为dd-cfDNA)是一种无创性的检测方法,可以更频繁、定量、更安全地评估移植物的排斥反应和损伤状态,且可以早期发现肾损伤,是肾移植术后一种新型、有前景的动态检测方法1。
ADMIRAL是一项大型、多中心、观察性队列研究,纳入了7个中心1092例成人肾移植患者,分析了从2016年6月至2020年1月期间dd-cfDNA的动态数据,评估与同种异体排斥反应的相关性2。
其中对203个病人取了219个活检标本,并同步做了血液GcfDNA检测,研究结果显示,活检无排斥反应患者的中位dd-cfDNA水平0.23%,显著低于活检显示有细胞或体液排斥反应患者中位dd-cfDNA的水平 1.6%(P < 0.0001)。然而活检显示无排斥反应患者和Banff定义的排斥反应患者的中位肌酐无统计学显著差异(1.38 mg/dL vs 1.57 mg/dL;P=0.096)。鉴别排斥患者dd-cfDNA的AUC为0.798,显著高于肌酐的AUC0.492(P < 0.001)(图1)。
关于dd-cfDNA与肾功能的关系,研究发现因移植后前4个月的eGFR不稳定,未发现明显关联趋势。而在第12个月和第36个月之间的动态肾功能监测分析表明,dd-cfDNA升高与随后的肾功能下降之间存在显著相关性(Spearman相关系数R:-0.84;P=0.01)(图2)。
dd-cfDNA升高(≥0.5%)与移植后3年eGFR下降显著相关,dd-cfDNA持续升高(≥0.5%)使eGFR下降25%的风险增加一倍(HR:1.97;P=0.041)。
另外,dd-cfDNA > 0.5%与新生供体特异性抗体(dnDSA)风险增加近3倍相关(HR:2.71;P=0.001)(图3)。在多变量分析中,dd-cfDNA水平每增加1%,dnDSA风险增加20%(HR:1.19;P=0.004)。研究表明dd-cfDNA可用于长期动态监测移植物功能、早期发现移植物损伤及排斥反应。
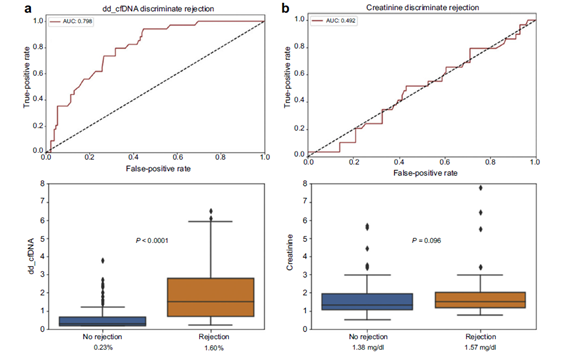
图1.有/无排斥反应患者中dd-cfDNA和肌酐水平
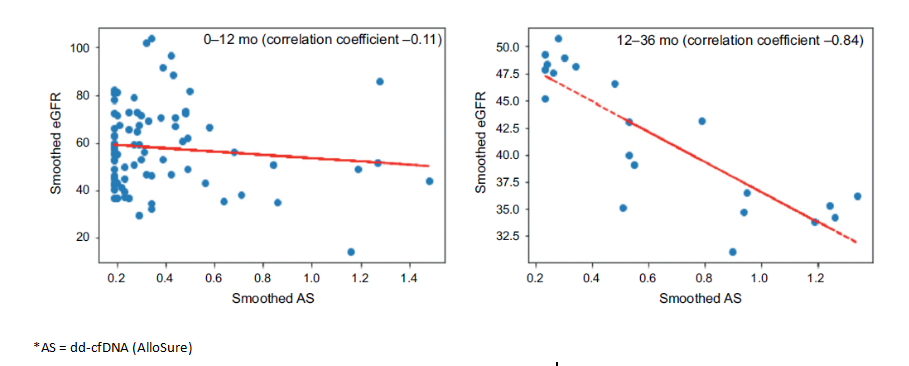
图2. 移植后36个月内,患者的eGFR与dd-cfDNA的关系
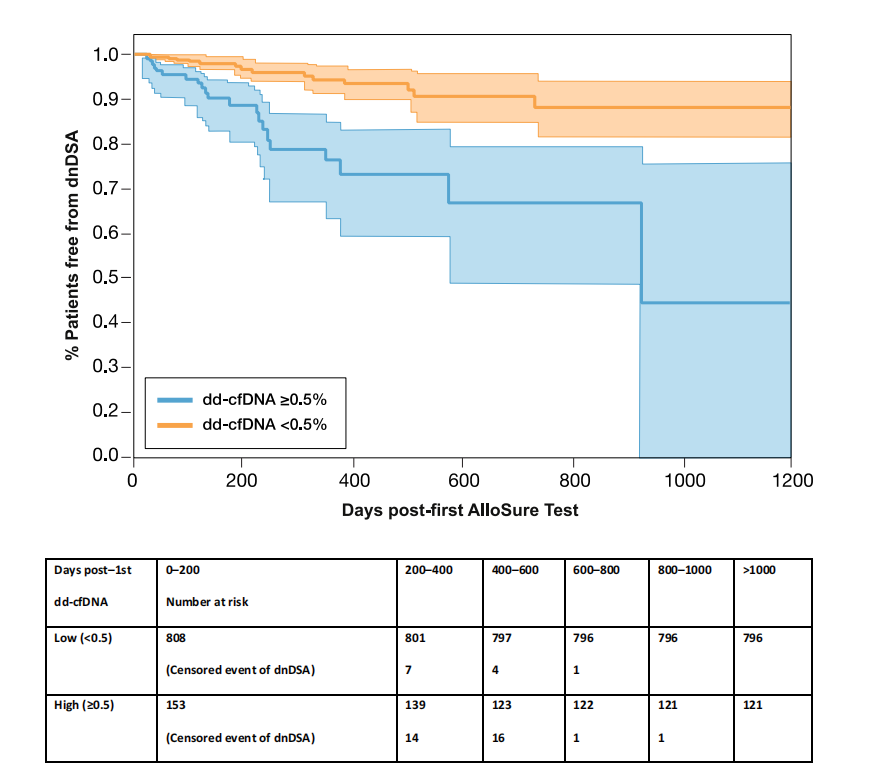
图3. dd-cfDNA与dnDSA 的关系
dd-cfDNA可长期动态监测术后移植物的排斥反应、肾功能与肾损伤,还可监测其他不利于移植物生存的因素,包括术后并发症、药物毒性、机会性感染以及原发疾病复发等。
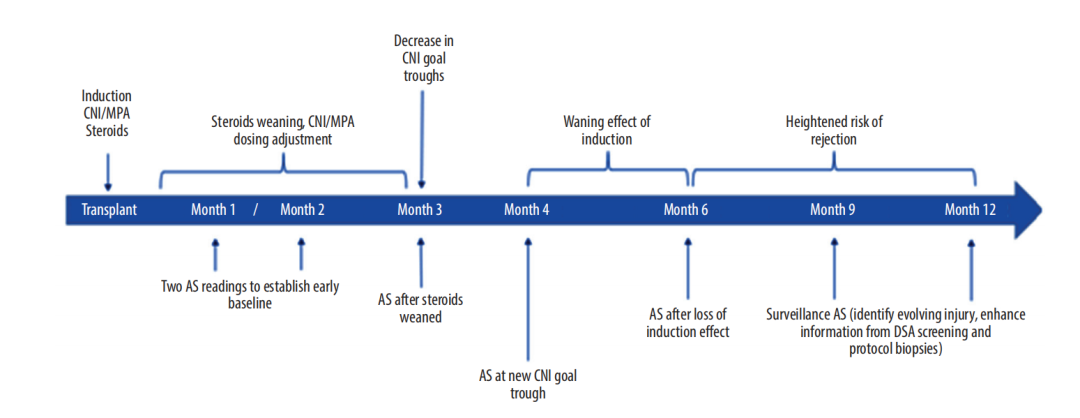
肾移植术后第1个月以术后愈合、移植物早期免疫排斥、术后并发症为主,dd-cfDNA有助于确立患者术后的基线水平、发现早期术后并发症以及急性排斥反应。
第2个月免疫抑制药物剂量通常会调整,dd-cfDNA有助于评估免疫抑制药调整后的变化,并可识别早期排斥反应。
第3个月免疫抑制药物减量与随后急性排斥反应风险的增加有关,dd-cfDNA有助于发现肾损伤、对临界患者进行风险分层。
第4个月随着患者从诱导治疗转变为单独口服治疗,排斥反应的风险会增加,这也是dd-cfDNA评估肾损伤的重要时间点。
第6个月和第9个月抗体介导的排斥反应(AMR)被认为是晚期移植失败的主要原因,而dnDSA与急性和慢性AMR有相关性,dd-cfDNA有助于发现dd-cfDNA与dnDSA的关联,以及有发生dnDSA风险的患者或移植物损伤的患者。
第12 个月伴随着新一轮的实验室检测和临床评估,dd-cfDNA有助于检测血清肌酐不敏感的亚临床分子损伤,并提供进一步的风险分层,有助于预测患者的长期预后。
第2年起建议每季度动态血液监测,以监测移植物功能的变化、免疫抑制剂的水平以及确定药物毒性和排斥反应是否发生,当dd-cfDNA增加时可为临床医生提供准确、敏感、无创的同种异体移植物损伤生物标志物,有助于早期识别排斥反应3。
总结
GcfDNA动态监测在肾移植术后具有重要的应用价值,可以动态、定量、无创地评估移植术后及药物动态调整后移植物的排斥反应、肾功能和肾损伤情况,考虑到经济因素,我们建议对于术后稳定的病人,可以在术后1个月、3个月分别检测,确立基线水平,对于高风险病人,我们建议术后1个月、3个月、6个月、9个月、后续按照季度动态监测,实现早发现、早诊断、早治疗,避免移植肾的过早失功。
参考文献:
1. Sam Kant et al.Donor-Derived Cell-Free DNA in Kidney Transplantation: Origins, Present and a Look to the Future . Medicina (Kaunas) . 2021;57(5):482.
2. Lihong Bu,et al. Kidney Int .Clinical outcomes from the Assessing Donor-derived cell-free DNA Monitoring Insights of kidney Allografts with Longitudinal surveillance (ADMIRAL) study . 2022 ;101(4):793-803.
3. Akshta Pai et al.Clinical Rationale for a Routine Testing Schedule Using Donor-Derived Cell-Free DNA After Kidney Transplantation . Ann Transplant . 2021;26:e932249.
扫码关注我们
微信号|Tx新方案
健耕医药,专注移植产业



