点击蓝字关注我们


前言
GcfDNA作为一种无创检测项目,在移植患者术后随访中具有重要作用。
多项研究表明GcfDNA不仅能够早期预警排斥反应的发生,还具有评估排斥反应治疗疗效、区分排斥反应类型等作用。
现将2022年TTS会议中GcfDNA相关汇报进行总结。
GcfDNA预测患者术后发生排斥反应
Mantios等人[1]纳入了32例因各种原因进行术后肾活检的患者,在活检时和治疗4周后测定GcfDNA。
AR组与未发生排异反应组患者的中位GcfDNA存在明显差异,分别为0.94%和0.24%;且ABMR和TCMR组患者的GcfDNA中位水平亦存在显著差异(13% vs 0.52%)。当切点设置在0.5%时,GcfDNA诊断AR的灵敏度为73.7%,特异度92.3%(图1)。
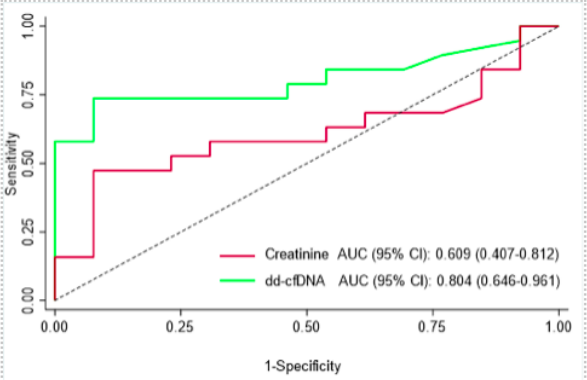
图1.GcfDNA和血肌酐对活检证实的AR的诊断性能
Alejandra等人[2] 对3年间共695名患者的3157次GcfDNA检测进行了回顾性研究。结果提示再移植、高敏患者、早期再手术患者的术后1月GcfDNA水平较高。术后1月活检阴性和阳性的移植患者GcfDNA(%)分别为(0.49±0.4)和(1.5±1.8)。
平均随访14个月显示,患者术后1月GcfDNA >1.0%时,随后的AR发生率为27%;患者术后1月GcfDNA≥2.0%,AR发生率升至50%。
该研究结果提示,术后1月GcfDNA>1%的患者存在更大的AR发生风险,需对这部分患者进行更加密切的临床随访。
GcfDNA预测患者术后发生排斥反应
Gohh等人[3]通过活检确认42例患者存在AR,同时进行了GcfDNA检测。随后对患者进行治疗,并随访60-150天。
结果提示治疗后GcfDNA水平出现明显降低,由1.11%降至0.35%,而同期eGFR并无明显变化(图2a)。单独分析ABMR/混合排斥反应及TCMR亚组时,上述结论依然成立(图2b-c)。
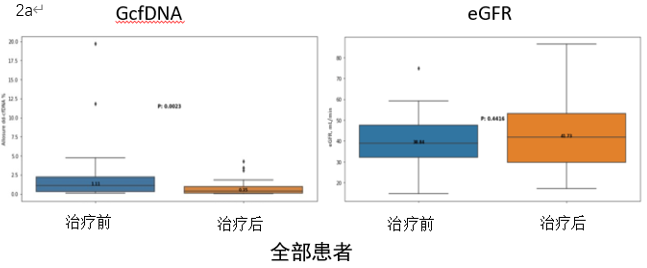
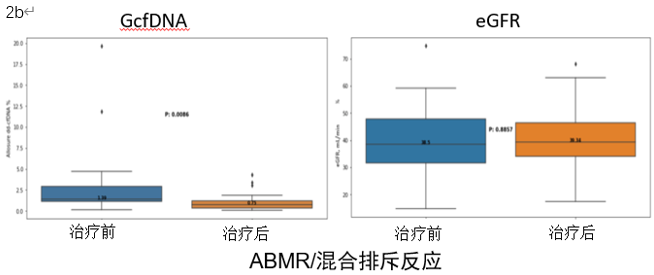
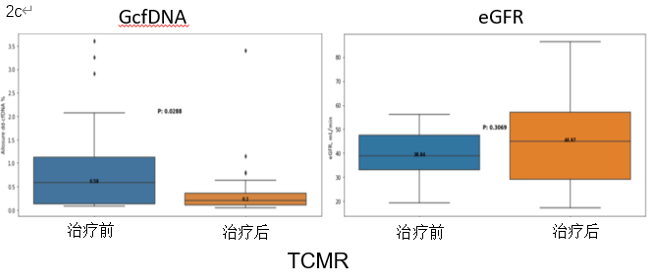
图2a-c:AR患者治疗前后GcfDNA和eGFR的变化情况
GcfDNA预测移植术后不良事件的发生
David等人[4]分析了1296例患者(KOAR研究)术后100天内的GcfDNA检测结果,并评估从术后100天开始患者的不良事件发生情况。
不良事件包括活检证实排斥反应、出现dnDSA及再次透析。该研究中共51例患者在术后100天内出现GcfDNA≥1.0%,这些患者术后1年内发生复合/单一不良事件的风险均明显升高(图3)。
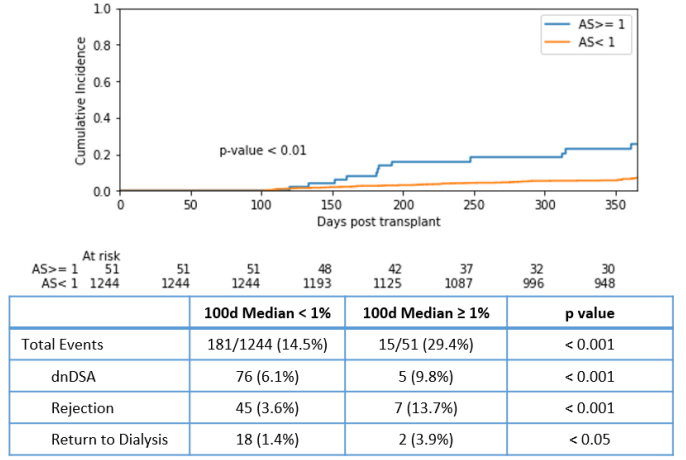
图3:术后1年内排斥反应、dnDSA及再次透析的发生率(AS,allosure)
该研究还发现,在纳入供体类型、受体年龄、受体致敏情况和DGF的多变量Cox比例风险模型中,只有术后100天GcfDNA升高≥1.0%可作为综合不良事件的预测因子,HR 2.99 (95% CI: 1.59 -5.61, p < 0.005)(表1)。
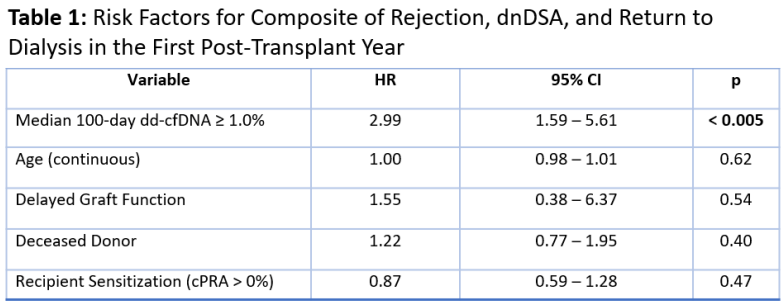
表1:术后1年发生综合不良事件的危险因素
Bogdan等人[5]纳入了2年内在华盛顿大学接受了GcfDNA检测的肾移植患者共171例,随访至少12个月。将GcfDNA升高定义为水平≥0.5%。
结果提示与GcfDNA未升高的患者相比,GcfDNA升高的患者eGFR下降更快(每月eGFR绝对值下降:0.21 vs -0.03 ml/min,GFR下降百分比8.7% vs -1.14%,p=0.09)(图4)。
此外,与DSA阴性或阳性且GcfDNA正常的患者相比,DSA阳性伴GcfDNA升高的患者eGFR下降百分比更大。在多变量logistic回归分析中,GcfDNA水平升高与eGFR百分比下降独立相关(OR0.96,95%CI 0.93-1.00,p = 0.05)。
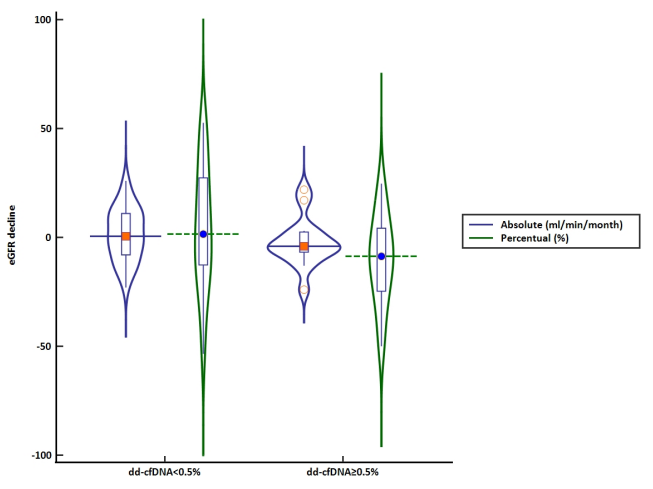
图4:不同GcfDNA水平组间患者eGFR的下降情况
总结
GcfDNA对于预测急性排斥反应、术后肾功能变化及评估排斥反应治疗疗效均具有一定价值,术后定期随访GcfDNA将使肾移植患者临床获益。
参考文献:
1.Evangelos Mantios, et al. Assessment of donor derived cell free DNA (ddcfDNA) at surveillance and at clinical suspicion of acute rejection in renal transplantation. 2022
2.Alejandra Mena-Gutierrez, et al. Donor-derived cell-free DNA testing in kidney transplantation: do one-month values have any prognostic significance? 2022
3.Reginald Gohh, et al. Donor-derived cell-free DNA (dd-cfDNA) for assessment of response after treatment of allograft rejection. 2022
4.David Wojciechowski, et al. Elevated donor-derived cell-free DNA (dd-cfDNA) in the early post-transplant period is associated with an increased incidence of adverse clinical outcomes in kidney transplant recipients. 2022
5.Bogdan Obrisca, et al. Elevated donor-derived cell-free DNA associates with subsequent decline of allograft function. 2022


